Germany
December 10, 2021
A collaborative project between researchers from the Max Planck Institute for Plant Breeding Research (MPIPZ), the French National Institute for Agriculture, Food and Environment (INRAE) and the U.S. Department of Energy Joint Genome Institute (JGI) has shed light on the fungal genetic determinants that explain why some fungi from the root microbiome can colonize roots and cause disease more efficiently than others.
Complex microbial communities inhabit plants and modulate their development. Roots especially, host a wide diversity of micro-organisms – including bacteria and fungi – that directly influence plant health. Researchers from the MPIPZ previously discovered that these fungi are important members of the root microbiome that can promote plant growth, but only when they are kept in check by the combined action of the host innate immune system and root-inhabiting bacteria (https://www.mpipz.mpg.de/pr-hacquard-2021-11).
In a new study published in Nature Communications, Fantin Mesny and co-authors provide novel insights into how these fungi colonize roots, why many of them are potentially harmful and what differentiates beneficial from pathogenic fungi in the root mycobiome (i.e., the fungal component of the root microbiota).
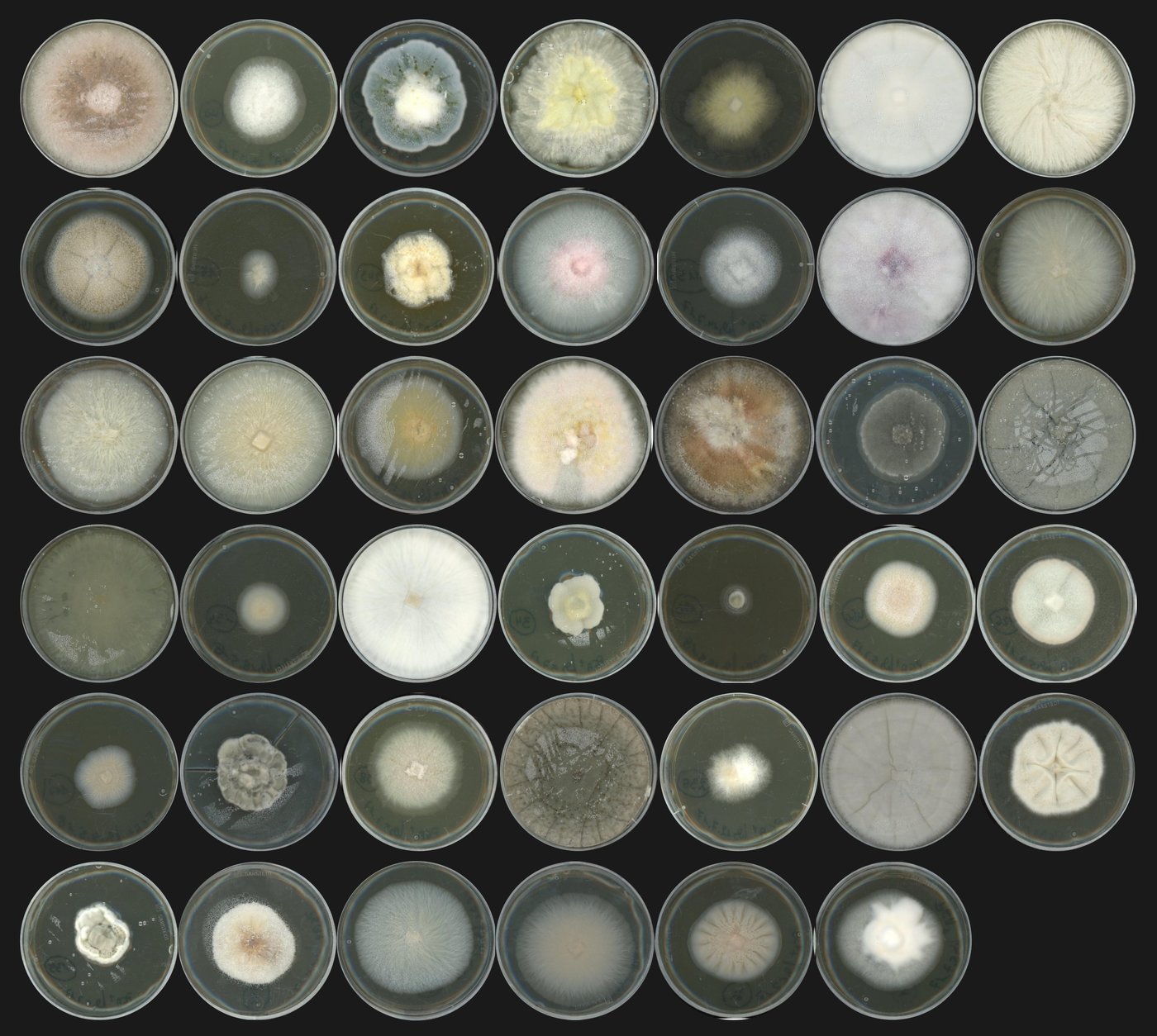
Figure 1. Photograph of 41 fungal isolates representative of the A. thaliana root mycobiome - © S. Hacquard / MPIPZ
To address these questions, the researchers focused on the model plant Arabidopsis thaliana (Thale Cress), which cannot rely on beneficial mycorrhizal fungi to acquire nutrients since it does not harbour the genetic network needed to establish a functional symbiosis with these fungi. A. thaliana likely relies on other fungi to compensate for the loss of mycorrhizal partners and to survive in nature. To better characterize these root-colonizing fungi in their broad diversity, researchers have isolated a variety of fungal strains from the roots of healthy plants across Europe and selected 41 that are representative of the root mycobiome of A.thaliana (Figure 1).
In collaboration with INRAE Nancy (France) and the JGI (USA), the genomes of these fungi were sequenced and compared to other fungi that were previously described as saprotrophic, pathogenic, endophytic or mycorrhizal. Surprisingly, the scientists found that most root mycobiota members – isolated from the roots of healthy plants – derived from ancestors that were likely pathogenic, and have retained a battery of genes that were previously shown to be lost in genomes of beneficial mycorrhizal fungi. These genes encode effector-like small secreted proteins that could modulate the host immune system, and enzymes that can degrade a large number of plant cell-wall constituents including pectin, cellulose and hemicellulose. These findings raised the possibility that many of these fungi may have retained at least part of their ancestral pathogenic capabilities.
To test this hypothesis, A. thaliana plants were grown in a closed system in the absence of any microorganism, or re-colonized with each of the selected 41 fungal isolates. This experiment identified a wide diversity of fungal effects on plant growth, ranging from highly detrimental to beneficial. Notably, the authors observed that the strains most harmful to the plant were colonizing roots much more aggressively than those having beneficial effects. Furthermore, the fungi most often detected in the roots of A. thaliana in nature were also the ones showing harmful effects on their host in mono-association experiments. Previous work from the group of Stéphane Hacquard had suggested that the mycobiome of A. thaliana can become detrimental when the host immune system and the root-inhabiting bacteria do not tightly control the proliferation of these fungi. These new results show that in nature, fungi with a high root-colonizing potential have a high pathogenic potential, explaining the need to control their growth.
Using a combination of association methods, including machine-learning models, the authors then associated the fungal effects on A. thaliana growth to genome compositions, and successfully identified a candidate gene family that could explain the detrimental effects and root colonization abilities. This family (pectate lyase PL1_7) encodes enzymes that degrade pectin, an essential constituent of plant cell walls, which is especially abundant in the roots of dicotyledonous plants such as A. thaliana. To validate its involvement in fungal detrimental activity, a gene from this family was introduced into the genome of a fungal species that naturally does not harbour it. The resulting mutant strain was able to colonize roots more aggressively than the original isolate and this increase in fungal load in roots was associated with a penalty on plant performance.
According to the last author of the study Stéphane Hacquard, “These results indicate that repertoires of plant cell-wall degrading enzymes in fungal genomes are key genetic determinants driving access to the root endosphere and explaining why robust root colonizers can potentially become harmful if they degrade roots too aggressively.”
This study highlighted that the mycobiome of healthy plants in nature is composed of both friends and foes. This finding offers a new perspective on the effects of fungi on plant health, and possibly opens the door to new exciting considerations and developments for agriculture. Taking advantage of these results could potentially provide a rationale on how to design and optimize synthetic fungal communities to obtain beneficial outcomes on plant performance.
Original Publication
1. Mesny F, Miyauchi S, Thiergart T, et al
Genetic determinants of endophytism in the Arabidopsis root mycobiome
Nature Communications 12, 7227 (2021)
Source
Le microbiote des racines à la loupe : reconnaître ses amis de ses ennemis
Des scientifiques mettent en lumière quels déterminants génétiques permettent aux champignons colonisant les racines de développer soit des associations bénéfiques, soit des interactions pathogènes. C’est le résultat d’un projet collaboratif impliquant le Max Planck Institute for Plant Breeding Research - MPIPZ, INRAE, l’université de Lorraine et le Joint Genome Institute. Ces résultats originaux, publiés le 10 décembre dans Nature Communications, améliorent les connaissances sur le fonctionnement du microbiote végétal et ouvrent de nouvelles perspectives sur la maîtrise des micro-organismes en vue de promouvoir la croissance des plantes.
Des communautés microbiennes complexes sont hébergées par les plantes et influent sur leur développement et leur croissance. Les racines, en particulier, abritent une grande diversité de micro-organismes, dont des bactéries et des champignons, ayant un impact direct sur la bonne santé des plantes. Dans cette étude originale, publiée dans Nature Communications, des scientifiques caractérisent quels gènes différentient les champignons bénéfiques des champignons pathogènes.
Afin d’étudier ces interactions entre plantes et champignons, ils utilisent une plante modèle : l’Arabette des dames (Arabidopsis thaliana). Cette plante est dépourvue du programme génétique qui lui permettrait d’établir une symbiose bénéfique avec les champignons racinaires mutualistes, qui aident la plupart des végétaux à acquérir des minéraux du sol. En contrepartie, l’Arabette a développé des interactions bénéfiques avec d’autres champignons vivant à l’intérieur des racines, les endophytes. A partir d’une large collection de champignons endophytes, les scientifiques ont sélectionné 41 souches représentatives du microbiote racinaire de l’Arabette afin de séquencer et d’analyser leur génome.
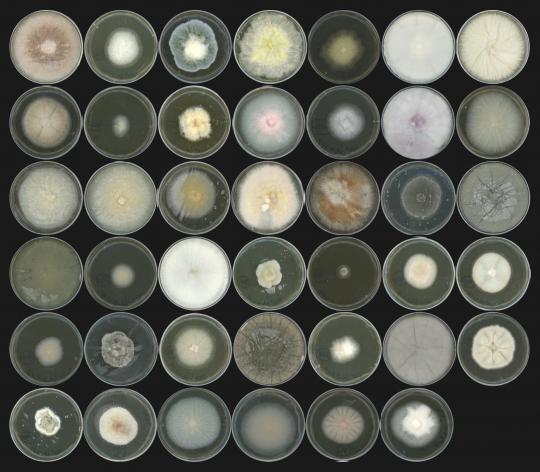 Photo : Les 41 souches de champignons isolées, représentatives du microbiote racinaire de l'Arabette des dames. © S. Hacquard / MPIPZ
Photo : Les 41 souches de champignons isolées, représentatives du microbiote racinaire de l'Arabette des dames. © S. Hacquard / MPIPZ
Ils comparent ensuite le génome de ces champignons endophytes à ceux d’une centaine de champignons symbiotiques, décomposeurs ou pathogènes. Résultat : la plupart des endophytes, isolés de plantes saines, avaient pour ancêtres des champignons pathogènes.
Quand ces champignons endophytes sont mis en contact individuellement avec l’Arabette, ils stimulent sa croissance ou au contraire, ils induisent des nécroses. Il apparaît que les souches néfastes colonisent les racines de façon beaucoup plus agressive que les champignons bénéfiques et dominent le microbiote racinaire, ce qui explique la nécessité pour la plante de contrôler leur prolifération.
Grâce à l’analyse fonctionnelle comparative de champignons endophytes bénéfiques ou pathogènes, les chercheurs ont réussi à identifier une famille de gènes facilitant la colonisation racinaire. Ces gènes permettent la fabrication de molécules qui dégrades un composant essentiel de paroi végétal : la pectine.
Pour confirmer le rôle de cette molécule dans la pathogénicité, le gène correspondant est inséré dans le génome d’un champignon qui en est naturellement dépourvu. Non seulement ce mutant est capable de coloniser les racines plus agressivement que la souche naturelle, mais son inoculation provoque une réduction de la croissance des plantes.
Ces molécules produites par les champignons, qui dégradent les parois de la plante, sont donc des facteurs critiques pour l’intrusion dans les racines. Lorsque leur prolifération n’est plus maîtrisée par le système immunitaire de la plante-hôte, les champignons du microbiote racinaire peuvent devenir pathogènes si leur capacité de dégradation est trop forte.
Cette étude montre la complexité du microbiote des plantes, composé d’un cortège de micro-organismes bénéfiques ou pathogènes qui sont en compétition, mais aussi étroitement surveillé par le système de défense de la plante. Grâce à une meilleure connaissance des équilibres qui régissent le microbiote végétal, cette découverte offre de nouvelles perspectives dans l’utilisation des champignons afin d’améliorer la santé des plantes cultivées.
Référence
Mesny, F., Miyauchi, S., Thiergart, T. et al. Genetic determinants of endophytism in the Arabidopsis root mycobiome. Nat Commun 12, 7227 (2021). https://doi.org/10.1038/s41467-021-27479-y